Ионохроматографическое определение коэффициентов анионного обмена K(Cl,A) на кремнеземах с привитыми олигоэтиленаминами
УДК 543.544:681.3Ионохроматографическое определение коэффициентов анионного обмена K(Cl,A) на кремнеземах с привитыми олигоэтиленаминами
А.В.Иванов, Е.М.Хасанова, Е.В.Макшина, П.Н.Нестеренко, А.В.Матвеев, А.Б.Тессман
(кафедра аналитической химии)
Определены коэффициенты анионного обмена хлорид-иона на анионы моно- и дикарбоксикислот на кремнеземах, модифицированных олигоэтиленаминами. Диапазон экспериментально определенных коэффициентов анионного обмена K(Cl,A) соответствует параметру, ранее использованному при моделировании внутренних градиентов рН в хроматофокусировании.
В последнее время исследователи уделяют все большее внимание моделированию химических процессов, поскольку оно помогает лучше понять процесс, позволяет значительно сократить время для оптимизации условий эксперимента, а значит, сократить и продолжительность эксперимента в целом. В ряде случаев на основании модельных представлений можно предсказать результаты эксперимента [1].
Одним из примеров моделирования является создание ионообменной динамической модели формирования внутренних градиентов рН в хроматофокусировании - варианте ионообменной хроматографии, использующем градиент рН в слое сорбента как инструмент разделения [1-4]. Модель учитывает гомогенные и гетерогенные равновесия в хроматографической системе, содержащей анионоообменник RNH2 на основе кремнезема с привитыми олигоэтиленаминами, и элюент, состоящий из набора слабых кислот HnA и оснований. Для получения более линейного, плавного градиента рН в элюент добавляют сильный электролит (NaCl) [4]; следовательно, элюент может содержать ионы Na+, Cl-; кроме того, хлорид-ион может вноситься в систему из стартового буферного раствора Трис-HCl. Таким образом, к варьируемым параметрам разработанной нами модели формирования градиентов рН относятся коэффициенты анионного обмена Cl- на анион слабой кислоты K(Cl,A), входящей в состав подвижных фаз:
(1)
(2)
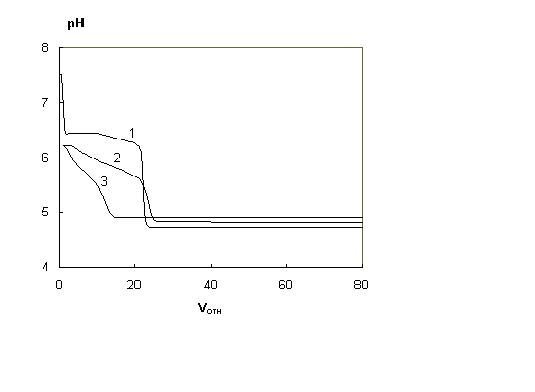
Профиль градиентов рН существенно зависит от величины коэффициента обмена хлорид-иона на анион кислоты - даже наиболее упрощенные расчеты (т.е. не учитывающие изменения протолитических свойств сорбента при снижении рН) показали, что при уменьшении значения K(Cl, A) от 0,1 до 0,01 сглаживаются ступени на профиле градиента, а диапазон линейности градиента расширяется до 2 ед. рН (рис.1).
Модель формирования внутреннего градиента рН является феноменологической, т.е. использует параметры, оцененные из экспериментальных данных для подобных систем [1, 4]. Так, ранее нами были экспериментально определены и использованы при расчетах градиентов рН константы протонирования аминогрупп сорбентов и коэффициенты катионного обмена K(H, Na) на сорбированных дикарбоновых кислотах [5]. В литературе [6-11] имеются многочисленные данные об обмене хлорид-иона на другие неорганические ионы, на анионы монокарбоксикислот для сильноосновных ионообменных смол ХИКС-1, Dowex-1Х8 или Dowex-2Х8 и САВ, содержащих четвертичные аммониевые основания в качестве функциональных групп. Для слабоосновных анионообменных смол типа Амберлит приведены только относительные ряды селективности, а для анионообменных сорбентов на основе модифицированных кремнеземов такие данные отсутствуют.
Данная работа посвящена экспериментальному определению коэффициентов анионного обмена K(Cl,A) на кремнеземах с привитыми группами этилендиамина (En-SiO2), диэтилентриамина (Dien-SiO2) и тетраэтиленпентамина (Tetren-SiO2).
Экспериментальная часть
Реагенты и растворы. Готовили 0,1 М растворы муравьиной, уксусной, щавелевой, малоновой, янтарной, винной, и малеиновой кислот и 0,05 М раствор фумаровой кислоты. Растворы всех кислот, кроме муравьиной и уксусной, готовили растворением точных навесок препаратов квалификации "ч.д.а." в бидистилляте. Растворы муравьиной и уксусной кислот готовили из концентрированных препаратов квалификации "о.с.ч. для ВЭЖХ" фирмы "Merck" (Германия). Раствор хлорида натрия готовили из фиксанала (VEB-Feinchemie, Германия).
В качестве элюента использовали 0,4 -0,8 мМ растворы фталевой кислоты при рН 3,45 - 3,50. Для регулирования рН в элюент добавляли рассчитанное количество 1 М раствора LiOH (“Реахим”, Россия).
В статических условиях исследовали сорбенты En-SiO2, Dien-SiO2 и Tetren-SiO2 на основе кремнезема Cилохром С-120 (удельная поверхность 120 м2/г, размер частиц - 100-160 мкм) с привитыми по методике [12] группами этилендиамина, диэтилентриамина и тетраэтиленпентамина, соответственно.
Аппаратура. В работе использовали хроматограф, состоящий из насоса высокого давления "Beckman-114M" (США), инжектора "Rheodyne-7125" (США) с объемом петли 20 мкл, стальной хроматографической колонки (250  4,6 мм), заполненной сорбентом на основе кремнезема с привитыми группами оксипролина Hypro-SiO2 (диаметр частиц 5 мкм), кондуктометрического детектора "Conductolyzer-5300 B" (LKB-Bromma, Швеция). Сигнал детектора регистрировали на самописце LKB (Швеция). Пробы растворов отбирали с помощью микрошприца "Hamilton" (США) объемом 25 мкл.
Кислотность растворов контролировали с помощью цифрового рН–метра "TOA Electronics HM–20S" (Япония) с комбинированным электродом.
Методика эксперимента. Точную навеску сорбента (0,50 г) промывали на стеклянном фильтре 20 мл смеси 0,1 М HCl и 1 М NaCl. Затем промывали сорбент 20 мл дистиллированной воды и количественно переносили навеску в пластмассовую пробирку емкостью. 15 мл. Добавляли 10 мл 0,01 – 0,02 М раствора исследуемой органической кислоты. Встряхивали в течение 5 мин, отбирали пробу с помощью микрошприца емкостью 15 – 20 мкл, и вводили в хроматограф. Состав эффлюента контролировали кондуктометрически. Измеряли высоты хроматографических пиков и рассчитывали содержание аниона кислоты и хлорид-иона по градуировочным графикам.
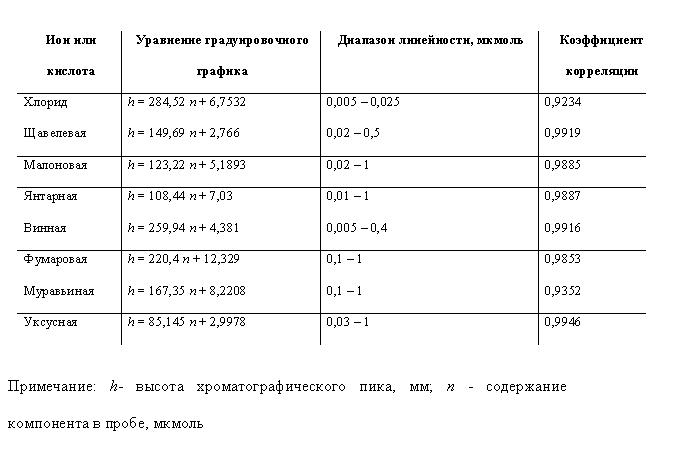
Построение градуировочных графиков. Готовили ряд стандартных растворов органических кислот и хлорида натрия с концентрацией 0,001 – 0,005 М, отбирали микрошприцем пробу объемом 5 – 20 мкл, и хроматографировали при кондуктометрическом детектировании. Строили зависимость высоты хроматографического пика от содержания компонента в пробе, мкмоль.
Обсуждение результатов
Выбор экспериментальных условий. В качестве исследуемых органических кислот были выбраны представители дикарбоксикислот предельного и непредельного рядов и монокарбоксикислоты. Предположительно, дикарбоксикислоты связываются с аминогруппами сорбента по одной карбоксильной группе, а вторая может быть либо в кислотной форме, либо, при более высоких рН, в виде натриевой соли. Кислоты непредельного ряда представлены фумаровой и малеиновой, являющимися цис- и транс-изомерами, у которых карбоксильные группы жестко связаны. Представителями гомологического ряда предельных монокарбоксикислот являются муравьиная и уксусная кислоты, дикарбоксикислот - щавелевая, малоновая и янтарная. С увеличением числа метиленовых звеньев константы диссоциации кислот заметно снижаются, а гидрофобность увеличивается, что усложняет механизм удерживания кислот на аминогруппах сорбента. Более сильные моно- и дикарбоксикислоты (например, муравьиная и щавелевая) позволяют достичь значений рН, при которых степень протонирования аминогрупп сорбента близка к 95-100%, однако при переходе к их гомологам трудно достичь степени протонирования аминогрупп хотя бы на уровне 90%, а иногда и совершенно невозможно [13]. Проводить эксперимент в условиях, при которых аминогруппы модифицированного кремнезема практически не протонированы, нежелательно, т.к. это соответствует рН>8-9, при котором происходит частичное растворение кремнеземной матрицы сорбента. Поэтому мы остановились на следующей схеме эксперимента: сорбент предварительно промывали смесью 0,1 М HCl и 1 М NaCl, что позволило полностью перевести аминогруппы в активную, т.е. протонированную, форму, а с другой стороны, обеспечило количественную сорбцию хлорид-иона на протонированных группах. Надо заметить, что если необходимую концентрацию хлорид-иона (1 М) создавать только с помощью соляной кислоты, то среда будет слишком агрессивная (рН ~ 0), что может привести к частичному разрушению сорбента. Использование же только раствора хлорида натрия в необходимой концентрации не позволит перевести все аминогруппы в протонированную форму. Затем сорбент промывали бидистиллятом и тем самым удаляли избыток хлорид-иона из пор сорбента. Ранее при определении коэффициентов катионного обмена K(H, Na) мы проводили ионный обмен в статических условиях, после чего хроматографически определяли концентрации натрия и анионов в аликвоте [5], поэтому в дальнейшем действовали аналогично.
Выбор условий хроматографирования. Для селективного разделения хлорид-иона и аниона исследуемой кислоты использовали 0,4 - 0,8 мМ растворы фталевой кислоты в качестве элюента. Наилучшее разрешение пиков хлорид-иона и большинства анионов исследуемых карбоксикислот достигнуто с использованием 0,5 мМ фталевой кислоты при рН 3,45, однако хроматографические пики малеата и хлорид-иона частично перекрывались, поэтому в дальнейшем с малеиновой кислотой мы не работали.
Полученные градуировочные графики представлены в табл.1.
Расчет коэффициентов анионного обмена. Расчет коэффициентов ионного обмена из экспериментальных данных основан на описании равновесия (1), или, в упрощенном виде:
(3)
(4)
Где , а (черта над ионом означает его нахождение в твердой фазе), q – максимальная емкость сорбента, m - масса сорбента, V - объем раствора.
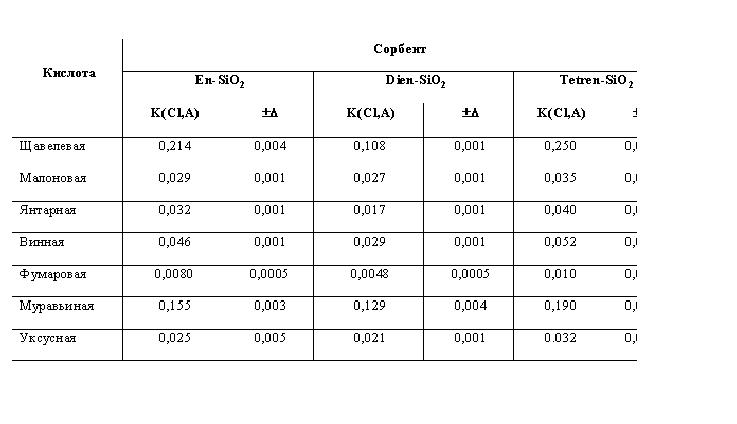
Проводили по три параллельных эксперимента для каждой карбоксикислоты, результаты обрабатывали статистически. Полученные коэффициенты анионного обмена на кремнеземах с привитыми олигоэтиленаминами представлены в табл. 2. Из таблицы видно, что для щавелевой и муравьиной кислот рассчитанные коэффициенты анионного обмена на сорбенте En-SiO2 оказались больше, чем для других кислот. Это может быть объяснено тем, что эти кислоты наиболее сильные в своих рядах. Кроме того, эффективный радиус молекулы этих кислот сравнительно мал. Известно также, что у щавелевой кислоты расстояние между карбоксильными группами примерно соответствует расстоянию между аминогруппами на поверхности сорбента [13, 14]. Для малоновой, янтарной, винной кислот коэффициенты получились достаточно близкими к значениям для уксусной кислоты, что косвенно подтверждает сорбцию этих кислот по одной карбоксильной группе. Видно, что коэффициент анионного обмена для фумаровой кислоты на порядок меньше, чем для других кислот. Это предположительно связано с тем, что фумаровая кислота имеет довольно низкую растворимость, что не позволяет достичь высокой концентрации кислоты в подвижной фазе.
Для сорбента Dien-SiO2 коэффициенты анионного обмена практически для всех изученных кислот получились меньше, чем для En-SiO2 (например, для щавелевой кислоты 0,214 на En-SiO2, 0,108 на Dien-SiO2; для винной - 0,046 и 0,029, соответственно). Это, по видимому, объясняется тем, что у сорбента Dien-SiO2 существенно ниже процент первичных аминогрупп, так как при модифицировании кремнезема диэтилентриамином привитые группы образуют не только линейные, но и циклические структуры, содержащие только вторичные аминогруппы [12]. Для сорбента Tetren-SiO2 коэффициенты анионного обмена опять повышаются, что связано с его более высокой обменной емкостью, но соотношение между коэффициентами для различных кислот в целом сохраняется.
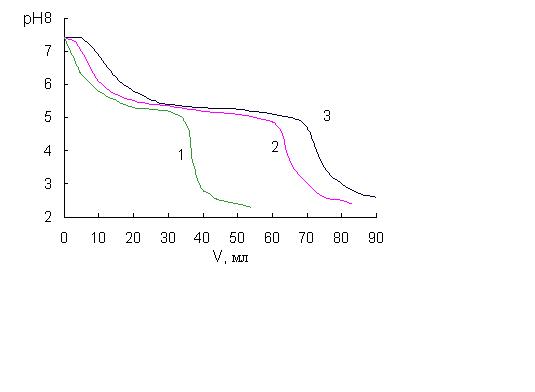
Соответствие модельных и экспериментальных градиентов рН. При моделировании внутренних градиентов рН [1, 4] использовали коэффициенты анионного обмена в интервале 0,01 - 0,3. Таким образом, поведение большинства изученных кислот описывается достаточно адекватно предложенной физико-химической моделью. Для получения экспериментальных градиентов рН хроматографическую колонку размером 50 х 4,6 мм, заполненную сорбентом Tetren-SiO2 (Силасорб Si-600 с привитыми группами тетраэтиленпенамина, 7,5 мкм), уравновешивали стартовым раствором (25 мМ трис-HCl) до рН 7,5 и пропускали буферный элюент (0,5 - 2,5 мМ H2C2O4), контролируя рН эффлюента в проточной ячейке [15] с помощью цифрового рН-метра и регистрируя сигнал на самописце. Полученные градиенты рН представлены на рис.2. При использовании элюента с меньшей концентрацией щавелевой кислоты градиенты становятся более плавными, однако общий вид сохраняется: рН эффлюента снижается до 6 за счет обмена хлорид-иона на анион кислоты, затем образуется ступень, после чего рН эффлюента снижается на 2 единицы. Протяженность ступени прямо зависит от содержания щавелевой кислоты. Как видно из сравнения рис. 1 (кривая 1 при K(Cl, A)) и рис.2, профили градиентов согласуются на качественном уровне - резкое понижение рН, ступень, опять понижение. Естественно, то профиль экспериментального градиента выглядит более плавным, что связано с полиэлектролитными и полибуферными свойствами аминогрупп сорбента, тогда как при моделировании для ускорения расчета эти свойства учтены минимально. Тем не менее, можно говорить об адекватности модели формирования внутреннего градиента рН.
Список литературы
1. Тессман А.Б. Дисс. ... канд. хим. наук. М.: МГУ, 2000, 158 с.
2. Хроматофокусирование полибуфером на ПБИ (russian translation). Stockholm-Uppsala, 1981. 40 p.
3. Sluyterman L.A., Kooistra C. // J.Chromatogr. 1989. V.470. P.317
4. Гармаш А.В., Тессман А.Б., Иванов А.В., Нестеренко П.Н. // ЖФХ. 1997. Т.70. №9. С.1683.
5. Иванов А.В., Нестеренко П.Н., Тессман А.Б.// Вестн. Моск. ун-та. Серия 2: Химия. 2001. Т.42. №1. C. 22.
6. Самуэльсон О. Ионообменные разделения в аналитической химии. М.: Химия, 1966. 416c.
7. Тремийон Б. Разделение на ионообменных смолах. М.: Мир, 1967. С. 34.
8. Ионный обмен. П/ред. Я.Маринского. М.: Мир, 1968. 568 с.
9. Либинсон Г.С. Сорбция органических соединений ионитами. М.: Медицина,1979. 182 с.
10. Иванов А.А. Дисс. ... канд. хим. наук. М.: МГУ, 1989. 195 с.
11. Долгоносов А.М., Сенявин М.М., Волощик И.И. Ионный обмен и ионная хроматография. М.: Наука, 1993. 220 с.
12. Нестеренко П.Н., Иванов А.В., Галева Н.А. и др. // ЖАХ. 1997. Т.52. №8, С. 814.
13. Тессман А.Б., Иванов А.В., Вакштейн М.С., Нестеренко П.Н.// ЖФХ. 2001. Т.75. №2. С.284.
14. Subramonian S., Clifford D.// Reactive polymers. 1988. V.9. Р.195.
15. Иванов А.В., Тессман А.Б.// Вестн. Моск. ун-та. Серия. 2: Химия. 1999. Т.40. №4. C.241.
Подписи к рисункам и таблицам
Рис.1. Расчетные градиенты рН при различных коэффициентах обмена K(Cl,A). Элюент - НА, pKa = 5.0; cHA = 2.10-3 M; cNaCl= 1.10-3 M. Сорбент - модельный с lg Kp = 8.0; K(Cl,A): 1 - 0.1, 2 - 0.03, 3 - 0.01.
Рис.2. Экспериментальные градиенты рН. Колонка: 50х4,6 мм, Tetren-SiO2 (7,5 мкм); стартовый раствор: 25 мМ трис-HCl (рН 7,5) I ~ 0; элюент: 1 – 2,5 мМ H2C2O4 (рН 2,6), 2 – 1 мМ H2C2O4 (рН 2,9), 3 – 0,5 мМ H2C2O4 (рН 3,2); 1 мл/мин; контроль рН в потоке.
Таблица 1. Градуировочные графики для хлорид-иона и органических кислот (условия: колонка Hypro-SiO2, элюент - 0,5 мМ фталевая кислота, рН 3,45, детектирование - кондуктометрическое).
Таблица 2. Коэффициенты анионного обмена K(Cl,A) при максима
Список публикаций (рус..)
База данных по профилям градиентов рН
http://sandro-i.narod.ru/Ionic.html
Протолититческие свойства кремнеземов с привитыми олигоэтиленаминами